2026-01-08 10:07:59
2025 年 7 月,默沙东公司通知研究者,KEYNOTE-937 研究没有达到主要研究终点,研究被终止并对患者进行了揭盲。在本周末的 ASCO GI 年会上,这项研究会公布主要研究结果。今天,研究的摘要在线发布。
KEYNOTE-937 是一项全球多中心、安慰剂对照的 III 期研究,一共入组了 959 例接受了手术切除或射频消融但伴有高危复发风险的肝细胞癌患者,按照 1:1 的比例随机接受帕博利珠单抗或安慰剂术后辅助治疗 12 月。
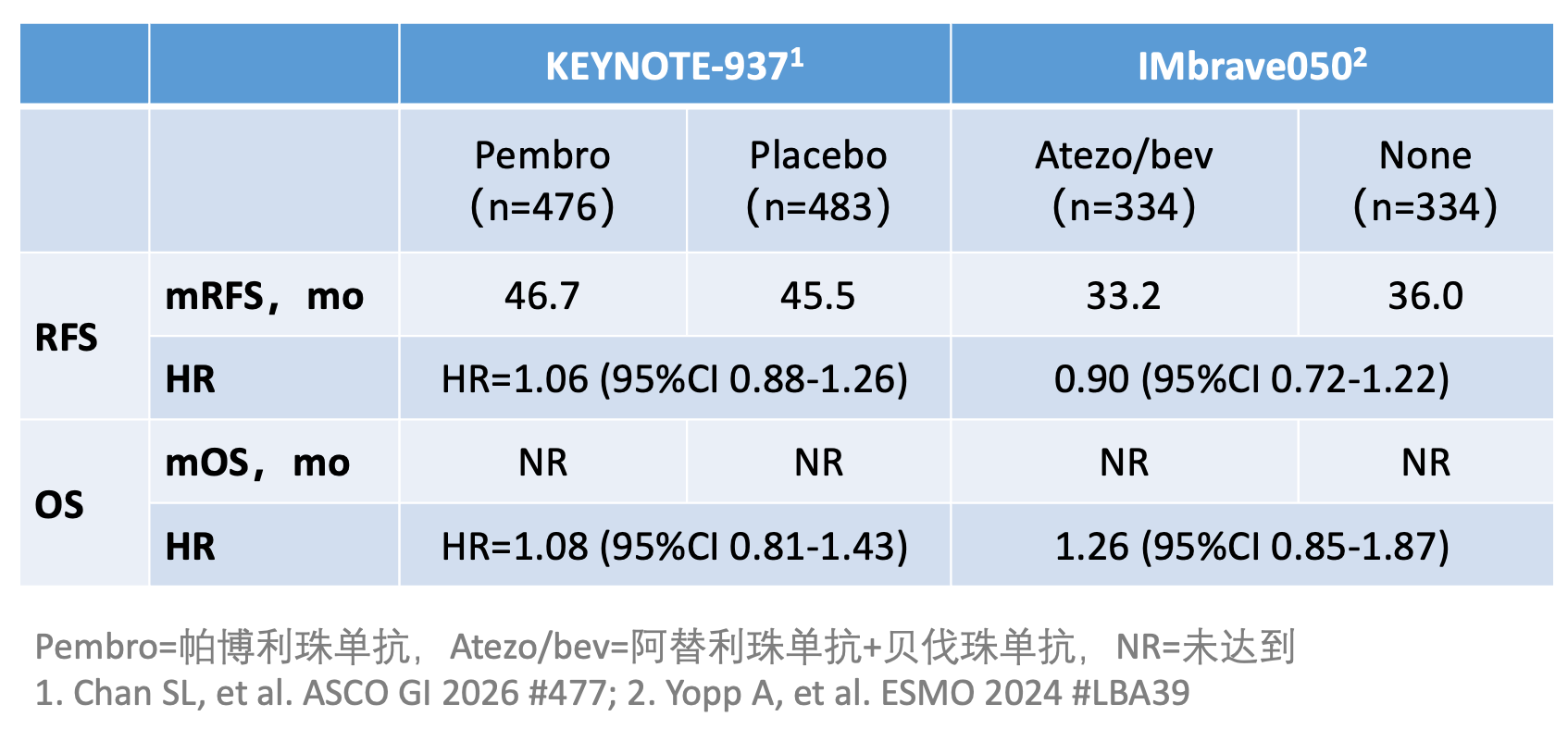
在 2025 年 3 月第 3 次期中分析时,中位随访了 50.7 月,帕博利珠单抗未能改善无复发生存期(RFS),两组的中位 RFS 分别为 46.7 和 45.5 月(HR=1.06,95%CI 0.88-1.26,P=0.719)。4 年的 RFS 率都是 50%。研究结果是阴性,虽然已经有了预期,但没有想到 RFS 一点儿改善的趋势都没有看到。两组的中位至复发时间分别为 52.5 和 50.1 月。此外,无远处转移生存期(DMFS)也未被改善(HR=0.98,95%CI 0.77-1.24),4 年的 DMFS 率分别为 71% 和 70%。
两组的中位生存期(OS)均未达到,也没有观察到改善的趋势(HR=1.08,95%CI 0.81-1.43,名义 P 值=0.704),4 年生存率分别为 79% 和 81%。
安全性方面,≥3 级的 AE 分别为 32% 和 22%,未发生药物治疗相关死亡。
连同本研究和 IMbrave050 研究,免疫治疗单独使用,或者联合贝伐珠单抗均不能降低肝癌术后的复发风险。如果将这两项研究做个对比,抗肿瘤血管生成治疗似乎在用药期间还可能降低复发风险,而免疫治疗没能起效。
期待本研究的结果在本周末被进一步披露,特别是分层分析的结果。
2025-12-28 19:32:58
今年 ASCO 全体会议上的同场评论“From Insight to Impact: Driving Plenary Knowledge into Action This Monday”,令我深有共鸣,直译成中文是:将全体会议上获得的知识化转化为下周一的临床实践。在回顾今年肝细胞癌的临床研究进展之后,我们有必要回归实践,审视这些发现将如何改变我们的治疗决策。

中国肝癌分期(CNLC)Ia-IIa 期的患者,指南推荐首选手术切除,但其中 Ib-IIa 期的患者,肿瘤较大或者肿瘤多发,手术后的复发风险比较高。以往,我们会先做手术切除,手术后再辅以预防性的经肝动脉化疗栓塞(TACE),部分中心也在尝试使用药物治疗来预防复发。但药物作为术后辅助治疗缺少高级别证据。目前多项回顾性研究提示,术后辅助免疫治疗可预防复发,但回顾性研究本身的偏倚无法克服。辅助治疗有效性的问题,还需要前瞻性的对照研究来回答。
去年的 ESMO 会议上,IMbrave050 研究(肝癌术后辅助治疗:阿替利珠单抗+贝伐珠单抗 vs 主动监测)更新了随访结果。该研究显示,阿替利珠单抗联合贝伐珠单抗(T+A 方案)辅助治疗不能改善 RFS,也不能改善 OS。晚期肝癌的优选治疗方案用于术后辅助治疗并没有出现意想的降低肿瘤复发的效果,这有些违背直觉,但我们不得不接受这个的现实。
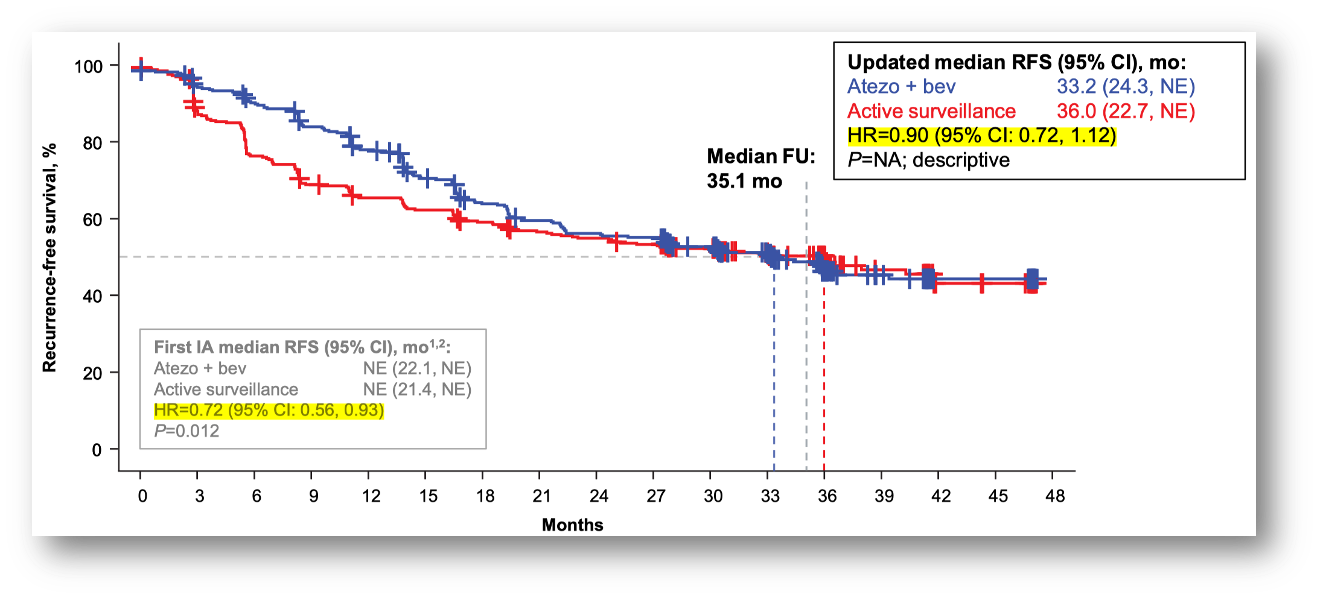
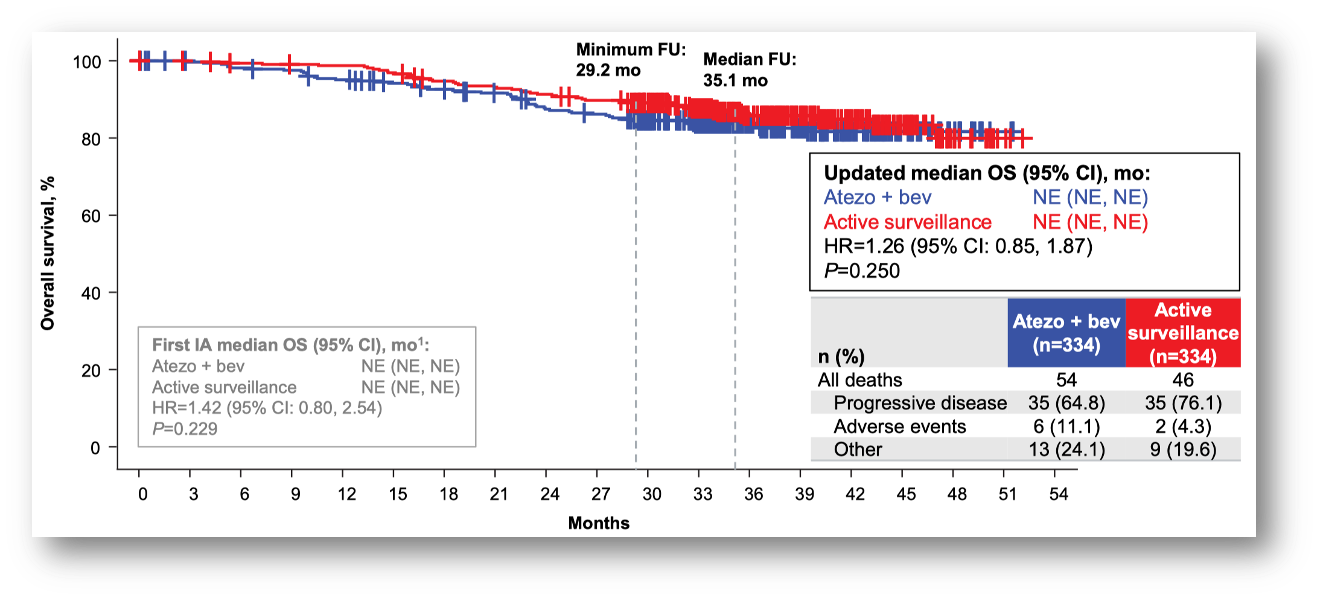
2025 年 7 月,KEYNOTE-937 研究(肝癌术后辅助治疗:帕博利珠单抗 vs 安慰剂)的申办方通知研究者,帕博利珠单抗辅助治疗也不能降低术后复发,该研究没能达到主要研究终点。这项研究预设的无复发生存期(RFS)的 HR 值是 0.7(即肿瘤复发风险下降 30%),现在的悬念是 PD-1 抗体到底能将肝癌术后的复发风险下降多少,我推测最终的 HR 可能在 0.90-0.95 之间,期待在即将到来的 ASCO GI 2026 会议上这项研究公布的结果。

但是,这项阴性结果的临床研究却可能会改变国内的临床实践。尽管缺少确切证据,在国内,靶向或免疫治疗被用于肝癌术后辅助治疗比较广泛,现在已经有两项研究明确提示了术后免疫治疗或靶向联合免疫治疗都是无效的,不知道国内的术后辅助治疗的应用能不能减少些。在 PubMed 上检索了肝癌术后免疫治疗回顾性研究,检索出来的 5 项研究无一例外都提示术后辅助免疫治疗可以降低肝癌复发。这提示,辅助治疗领域的回顾性研究存在很大偏倚,以至于跟前瞻性的研究出现了相反的结果。
至此,药物用于肝癌术后辅助治疗的几项大型研究均宣告失败,术后使用靶向治疗(索拉非尼,STORM 研究)、免疫治疗(帕博利珠单抗)、或靶向联合免疫治疗(T+A 方案)均不能降低复发。基于这些证据,除非是患者接受的是非根治性的手术,否则术后使用药物作为辅助治疗的必要性都不大。
那中高危复发的肝癌患者只有先接受手术,手术后密切随访,被动等待?
根据免疫治疗的作用机制,将免疫治疗提前至手术前使用,可能具有更大的优势。在主瘤存在时开始免疫治疗,可以诱发出更为多样和强效的免疫反应;手术切除后续贯用药,则可能有更好的免疫监视作用。今年的 ESMO 年会上,CARES-009 研究公布了无时间生存期(EFS)的结果。该研究入组了初始可手术切除 CNLC Ib-IIIa 期患者,术前接受 2 个周期的双艾组合(阿帕替尼+卡瑞利珠单抗)治疗,手术后续贯双艾治疗(围手术期治疗模式),最长1年时间;对照组则直接接受手术切除。结果显示,与直接手术相比,围手术期治疗显著改善了 EFS。通俗讲,术前+术后的围手术期治疗模式可以显著推迟肝癌术后复发。并且,CNLC Ib-IIa 期这些指南推荐首选手术切除的患者也从围手术期治疗中获益。
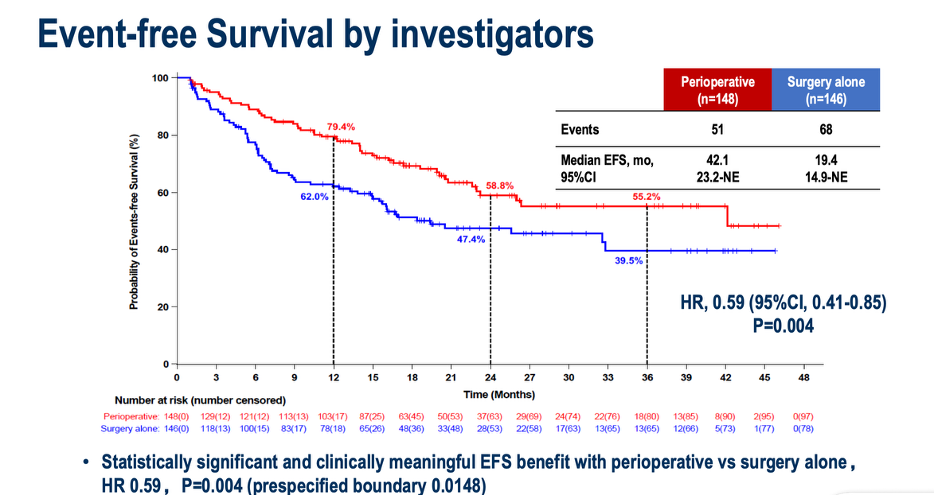
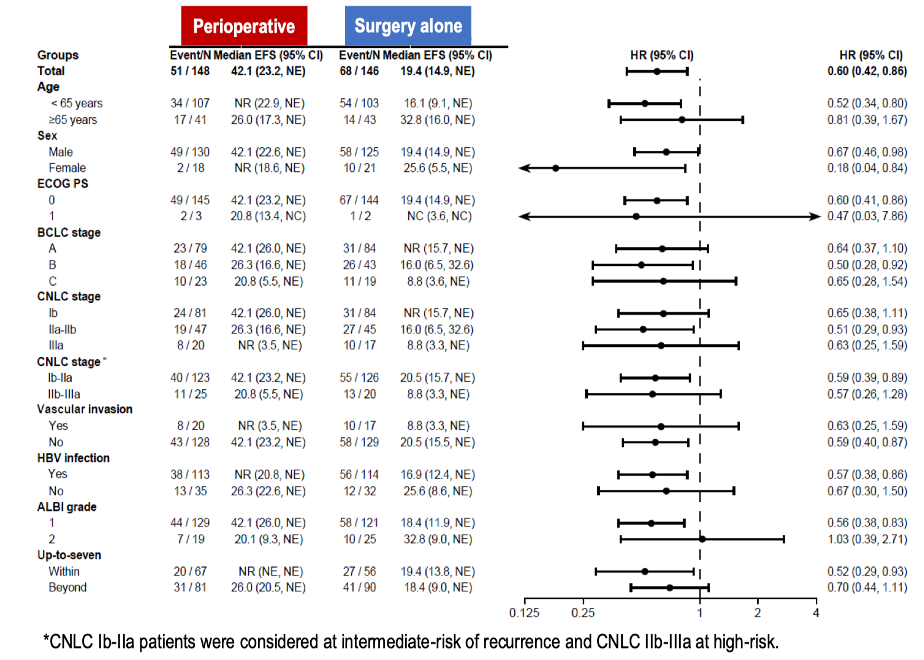
该研究是可切除肝癌治疗模式的革新,具有高危复发因素的可切除肝癌 可以考虑 推迟手术,先接受系统治疗作为术前的新辅助治疗。如果在进一步的随访中可以观察到 OS的改善(或改善趋势),该方案可成为这些患者的标准治疗手段。在临床实践中处理具体患者时,还要考虑新辅助治疗疗程的个体化,并可根据病理学反应结果确定术后续贯治疗的方案和疗程。
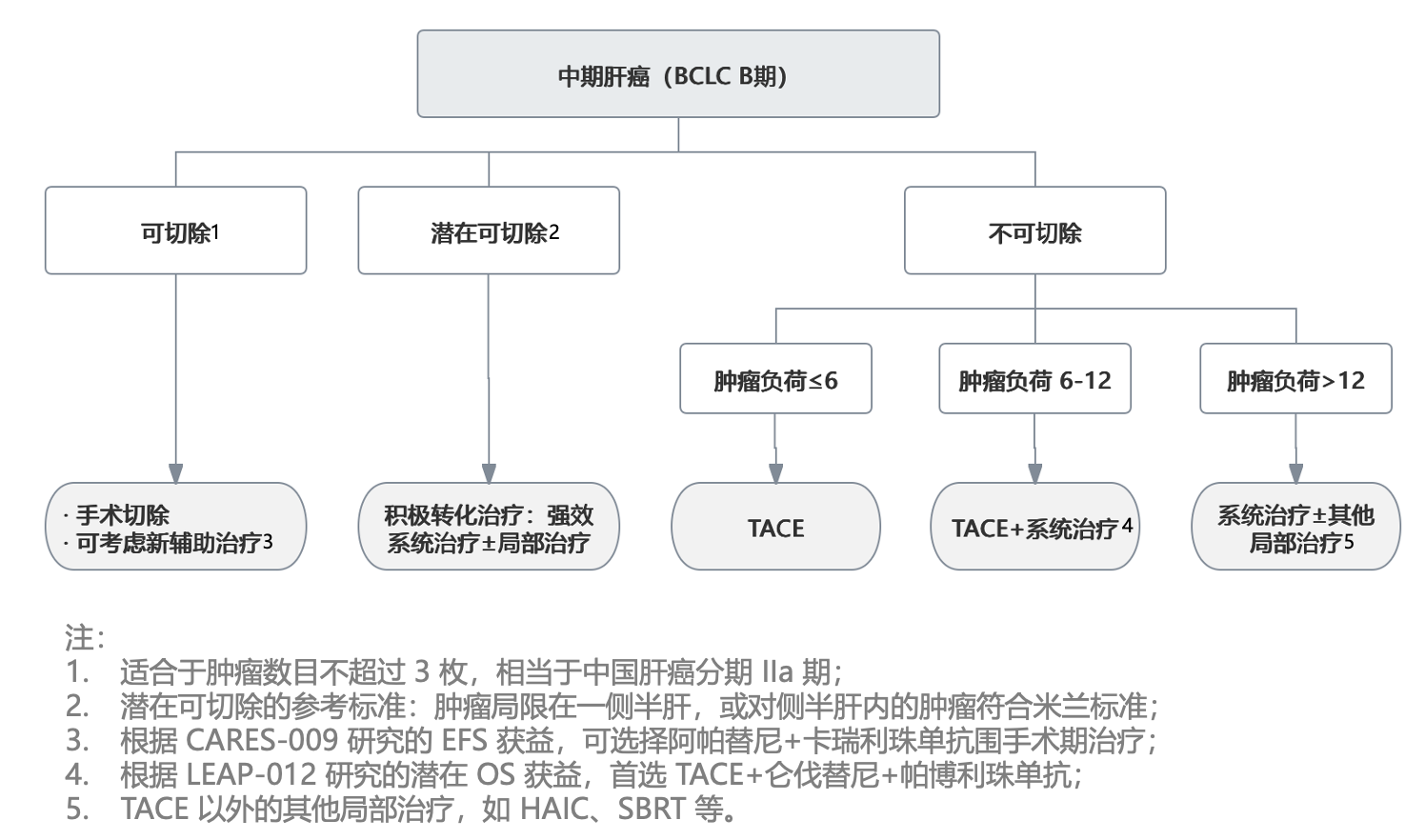
一直以来,中期为主的肝癌(包括不可切除早期和门静脉远端分支癌栓的晚期肝癌)被认为是适合 TACE 治疗的人群,在 TACE 治疗无效之后,再接受系统治疗,这就是 中期肝癌传统的 TACE 续贯系统治疗模式。现在晚期肝癌的系统治疗取得了较大进步,如果在 TACE 治疗失败之前就开始使用系统治疗,可以形成 TACE 联合系统治疗的模式。联合治疗是否可以胜过续贯治疗,需要通过随机对照研究来评价。
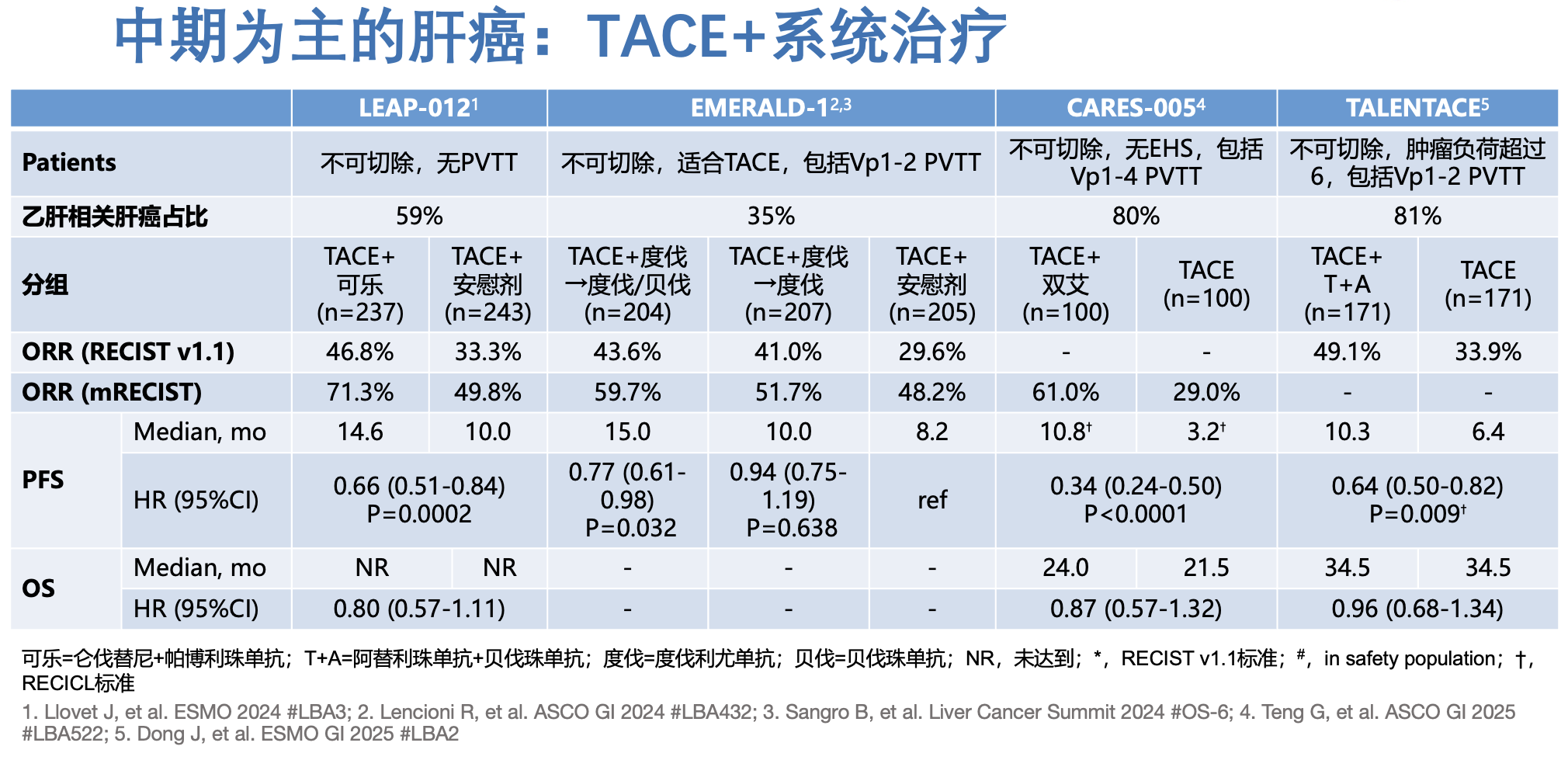
该领域已经有了 4 项随机对照研究公布了主要研究结果。这些研究使用的系统治疗方案不同、联合治疗的顺序有少许差异,但都提示在 TACE 治疗的基础上增加靶免治疗可以提高 ORR、显著改善 PFS。目前这些研究的 OS 数据都不成熟,但从已经公布的结果看,OS 的显著获益都难以达到。其中 LEAP-012 研究中 OS 的获益趋势最为明显,HR=0.80。但今年 10 月, 默沙东和卫材公司公告 该研究的 OS 期中分析未达到统计学差异,并且预期后续的 OS 分析也难以达到预设的统计学差异。这样一来,对于中期肝癌患者,系统治疗早用或者晚用对似乎对 OS 的影响不会太显著。那对于中期肝癌患者,TACE 等局部治疗还要跟系统治疗联用呢?个人认为,中期肝癌还需要进一步分层,首先根据患者的可手术切除状态进行分层,再根据肿瘤负荷确定治疗方案。
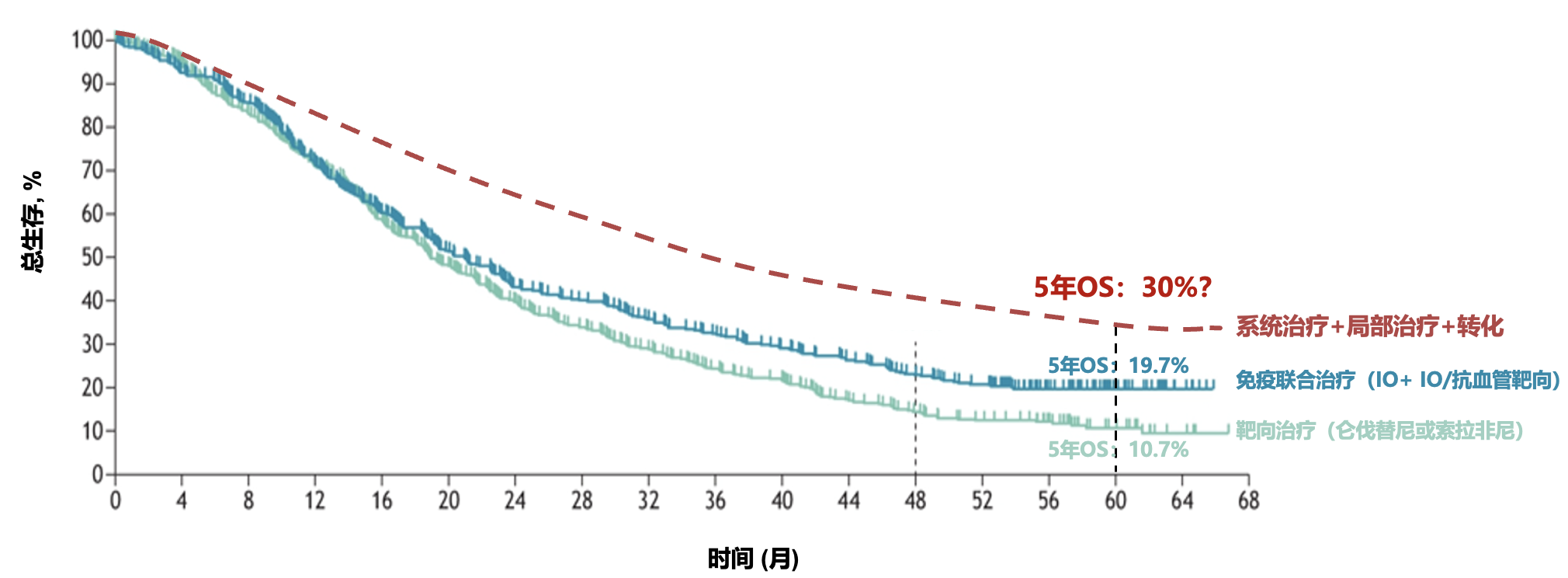
目前,不可切除或晚期肝癌的优选一线治疗方案都是免疫联合治疗,包括靶向联合免疫治疗和双免疫治疗。在免疫联合治疗时代,我们终于有机会讨论晚期肝癌的长期生存了。目前有两项 III 期研究公布了长期随访的结果,接受 STRIDE 方案(单次曲美木单抗+持续的度伐利尤单抗)双免疫治疗或可乐组合靶向联合免疫治疗的晚期肝癌患者的 5 年生存率都在 20% 左右。
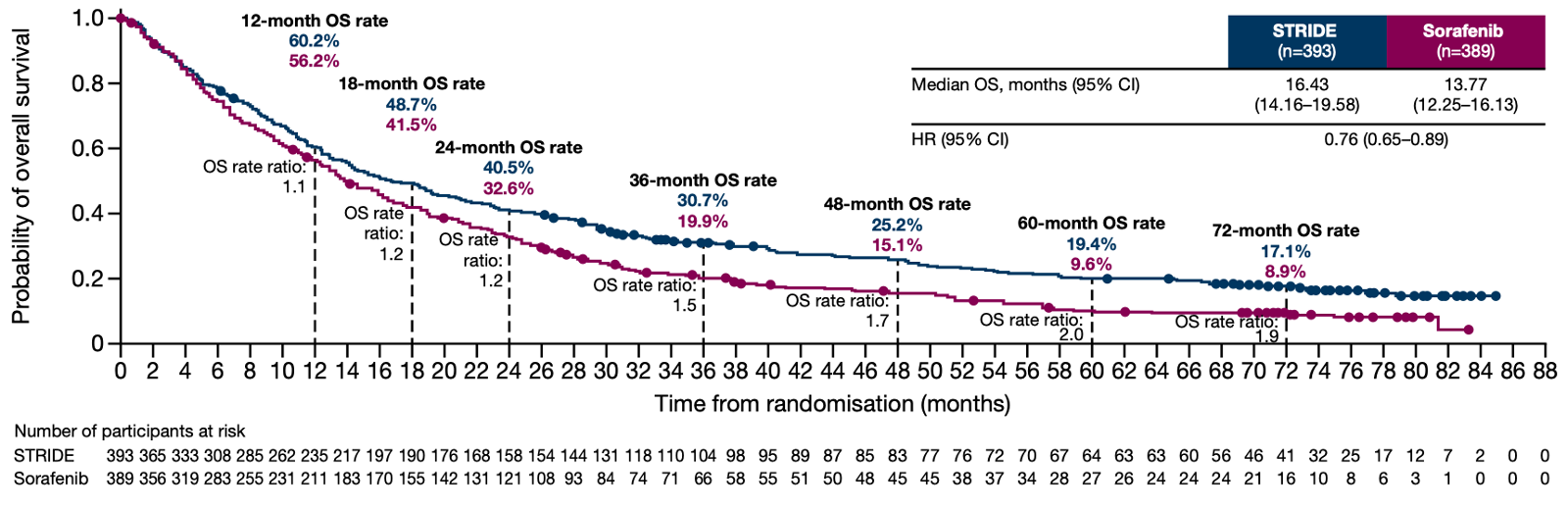
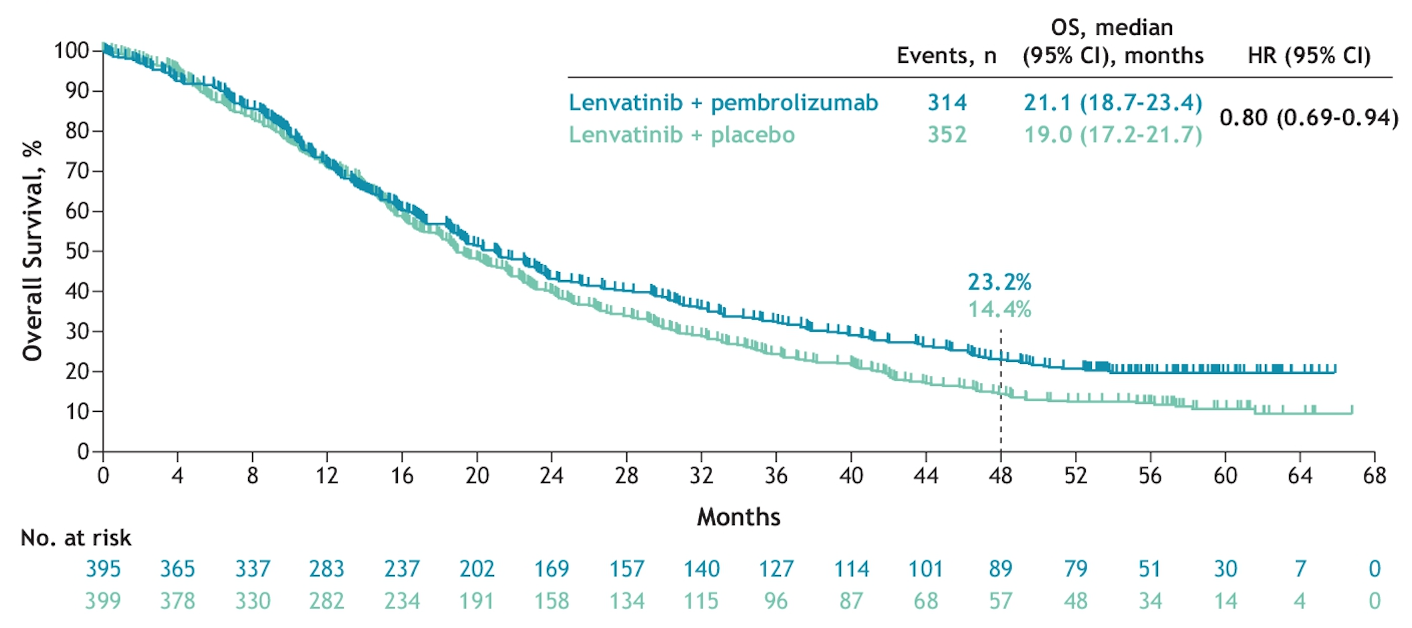
这些长期生存的患者可能大多是对免疫治疗获益的患者。为了进一步提高疗效,在现有治疗的基础上做加法可能是可行的方案。然而,今年 ESMO 会议上,有两项研究试图在现有标准一线治疗(T+A 方案)的基础上增加一种免疫治疗,但结果都不理想。
IMbrave152 研究中,在 T+A 基础上增加 TIGIT 抗体 tiragolumab 治疗,未能有效提高 ORR,也未能改善 PFS 和 OS。
研究者发起研究 TRIPLET HCC 显示,在 T+A 基础上增加小剂量 CTLA-4 抗体伊匹木单抗也没能进一步提高疗效。
如果没有更有效的药物出现,临床上灵活使用系统治疗和局部治疗手段可能为患者赢得更好的长期生存。在今年 ESMO 会议上,TALENTop 研究公布了主要研究结果。这项研究将接受 T+A 方案治疗 4 个周期后未出现肿瘤进展且可以手术切除晚期肝癌患者进行随机分组。治疗组接受手术切除,术后续贯使用 T+A 方案最长一年;对照组则接受 T+A 方案持续用药。研究显示,手术切除比持续系统治疗有更长的至治疗失败时间(TTF)获益,换句话说,手术切除延缓了患者一线接受 T+A 方案的失败时间,避免了患者出现治疗失败从而需要接受二线系统治疗;此外,OS 也显示出了改善的趋势。
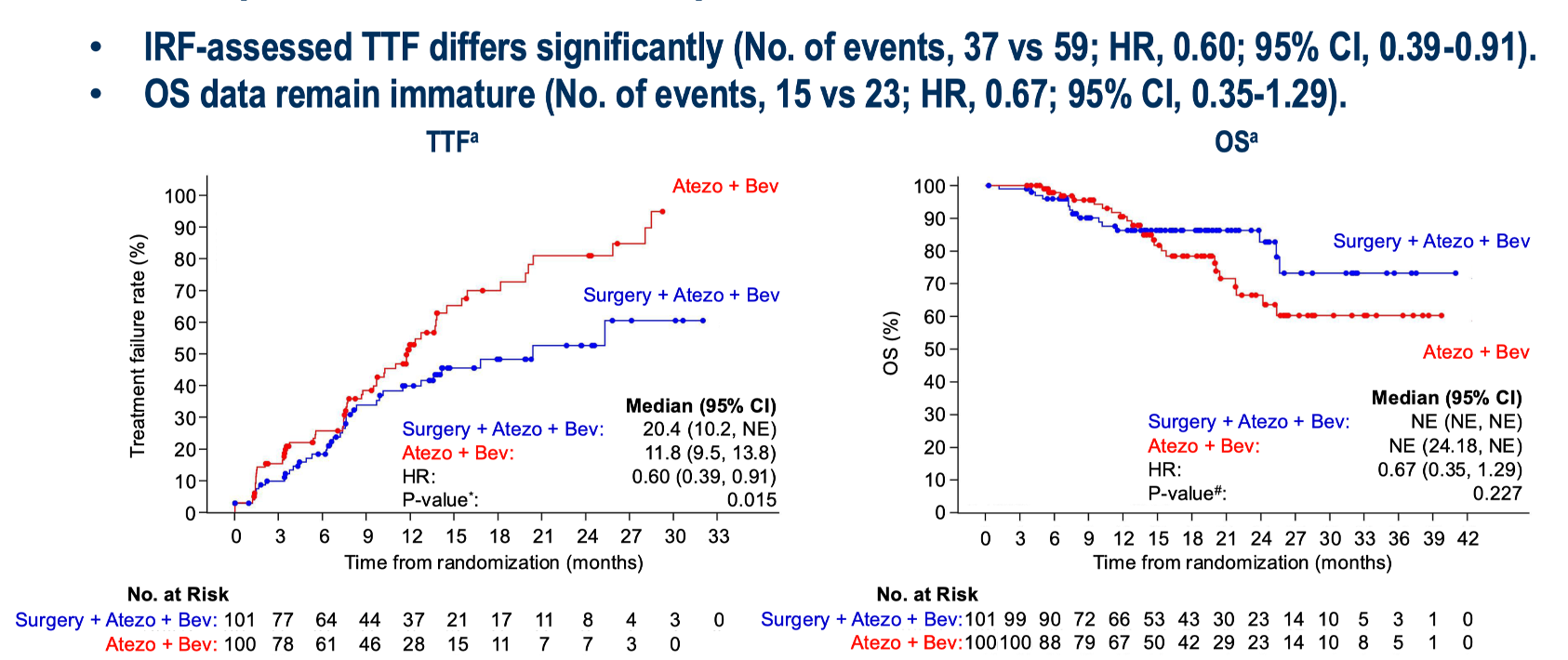
这项研究是首个通过前瞻性的对照研究证实了晚期肝癌成功转化后手术切除的价值。这也为晚期肝癌的系统治疗的疗效提升提供了可行的方案。绝大部分晚期患者无法被系统治疗所治愈(5 年生存率~20%),如果患者在治疗有效时接受适时的手术切除,则可以争取无瘤生存的机会,进而可能转变成长期生存的机会。
TALENTop 为转化治疗领域的研究提供了一个基本框架,后续的研究和临床实践可以在此基础上进一步优化。在临床工作中,可根据患者的实际情况,选择合适的转化治疗方案(例如考虑增加局部治疗),根据患者的治疗反应调整转化治疗的时长,手术后的续贯治疗都可以根据患者的治疗反应做相应调整。
对于晚期肝癌患者,在缺少生物标志物指导治疗方案选择时,我们还是根据其对系统治疗的反应动态调整治疗策略:
这种根据治疗反应按需调整治疗方案的策略可能为更多晚期患者赢得长期生存的机会,也许,5 年 OS 率可以提高到 30% 以上?
2025-11-15 18:23:03
前几天参加了一个学术会议,会中设置了一个投票环节,针对几个问题,收集现场参会医生的看法。其中一个问题是:对于有特点靶点变异的晚期胆道癌(BTC)患者,一线治疗首选靶向治疗还是按照常规使用化疗联合免疫治疗? 现场收集到的投票结果有些超出我的预料。
最近几年,晚期 BTC 的一线标准治疗方案终于从 GC(吉西他滨+顺铂)化疗升级成了化疗联合度伐利尤单抗或帕博利珠单抗治疗。但遗憾的是,患者的中位生存期仍然停留在 1 年左右。显然,大家对这个数据都不满意。肿瘤组织的进一步检测可以帮助少数的胆道癌患者发现某些靶点的变异,其中较为常见(比例的绝对值很低)是 IDH-1 突变、FGFR2 融合或重排、HER-2 高表达或扩增。在目前的临床试验中,针对这些靶点的靶向治疗在化疗失败的 BTC 患者中都显示出了一定的治疗活性,一些治疗的有效率比较亮眼,佩米替尼和泽尼达妥单抗在国内外也分别获批了 FGFR2 融合/重排和 HER2 3+ 的 BTC 后线治疗的适应证。那是否可以考虑把这些靶向治疗移到一线治疗,让这些患者尝试去化疗的方案呢?
个人认为,对于多数 BTC 患者,一线还应首选化疗联合免疫治疗,这些靶向治疗还应放在后线。
各个靶点的变异的治疗疗效和副作用差别较大,需要分开讨论。下表列出了 BTC 常见系统治疗的疗效和安全性数据。
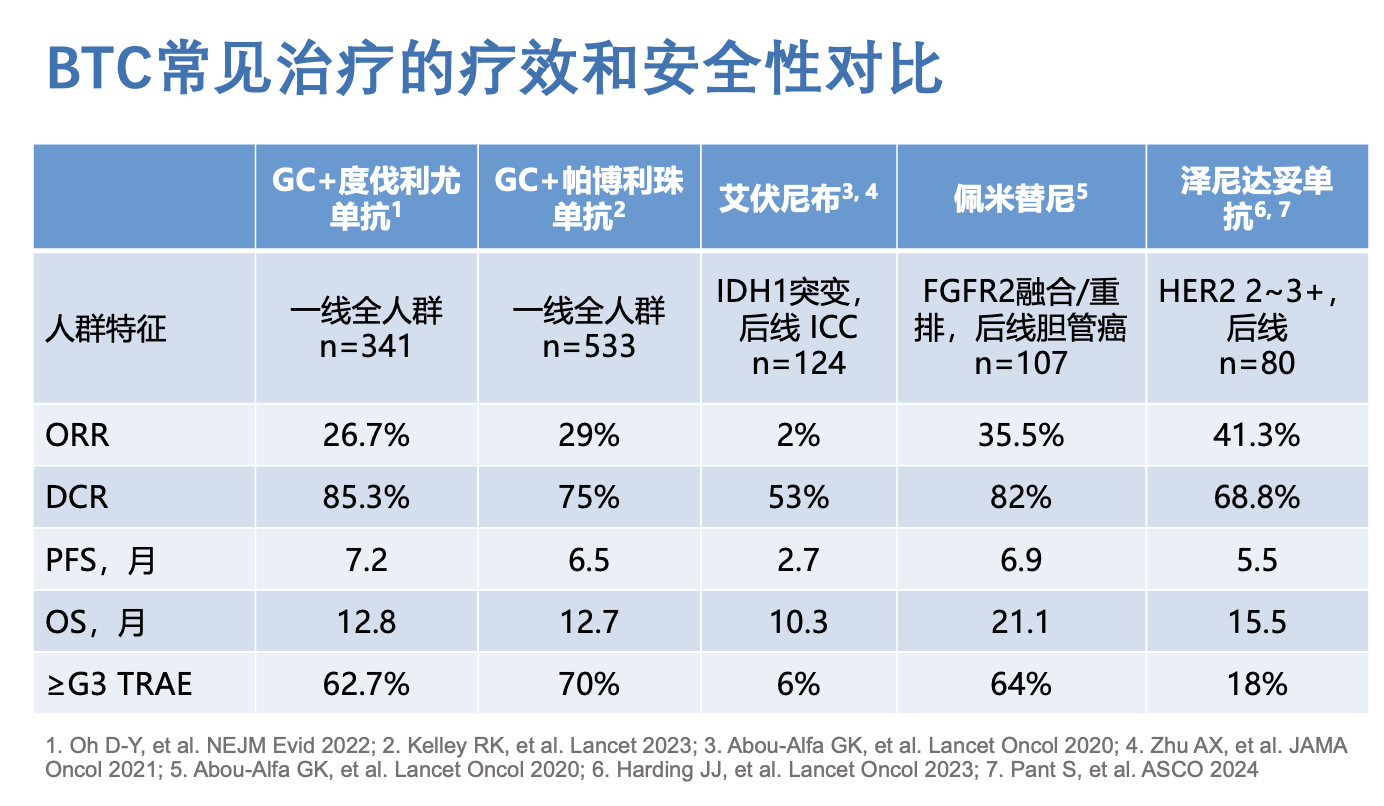
在 ClarIDHy 研究中,IDH-1 突变的患者后线使用艾伏尼布可以显著延长无进展生存期(PFS),临界延长总生存期(OS)。这个药物的不良反应不大,但是治疗效果比较一般,疗效主要主要还在于稳定肿瘤,而不是缩小肿瘤。在这项临床试验中,ORR 只有 2%,中位 PFS 也只有 2.7 月。
针对这个靶点的药物有多种选择。佩米替尼也已经在国内获批了适应证。这个药物的疗效确实不错,在全球的 FIGHT-202 研究中,ORR 35.5%,应该算是缩瘤效果不错,但不良反应比较高,3 级及以上的治疗相关不良事件(TRAE)发生率高达 64%,安全性不算太好。中国区的桥接试验中,疗效数据同样不错,ORR 达到了 50%。还有其他同类药物在国外获批,例如 Infigratinib,整体疗效和不良反应发生跟佩米替尼相似。
有两项随机对照研究尝试将这两个药物用于 FGFR2 阳性 BTC 的一线治疗,也算是这两个药加速获批后的确证性研究。但很遗憾的是,两项临床试验都提前终止。其中,PROOF 301 研究公布了初步的结果,前文也讨论过。整体而言,一线使用 Infigratinib 抗 FGFR2 靶向治疗的疗效数据不比单独化疗更好,且高级别不良反应的发生率比化疗还要高。如果跟现在的标准治疗(化疗+免疫治疗)相比,那疗效可能还比不上。此外,佩米替尼与化疗对比的 III 期研究 FIGHT-302 也提前终止了。针对这个靶点还有几个在研的靶向药,不排除以后会有疗效更好、不良反应更低的同类药物在日后可以取代化疗成为一线治疗,但现在可及的抗 FGFR2 治疗一线应用还不太合适。
HER2 阳性 BTC 一般指的是免疫组化染色 3+,或者免疫组化 2+ 且 FISH 检测阳性。在国内外,泽尼达妥单抗已经获批了 HER2 3+ 患者后线治疗的适应证。整体而言,泽尼达妥单抗在 BTC 的表现不错,用于 3+ 的患者,ORR 达到了 51.6%,不良反应可以接受。另外,抗 HER2 的 ADC 药物(如德曲妥珠单抗)也显示了不错的疗效和可接受的不良反应。整体感觉是,这两种抗 HER2 治疗的疗效和安全性比 FGFR2 阳性患者接受抗 FGFR2 治疗要更好。那 HER2 阳性患者能不能考虑一线治疗中跳过化疗呢?从别的瘤种的经验来看,似乎可以这么考虑,但遗憾的是,开发这两个药物的公司似乎还没有足够的信心。
有两项在研 3 期研究,HERIZON-BTC-302 和 DESTINY-BTC01,在评估将泽尼达妥单抗或德曲妥珠单抗用于 HER2 阳性 BTC 的一线治疗,研究的对照组都是化疗+免疫治疗,但治疗组也没有敢于单独使用靶向治疗,而是选择跟化疗和免疫治疗的联合。从目前正在开展的临床试验看,HER2 阳性的患者能否一线治疗中去除化疗,短时间我们还得不到确切回答。
但是,有一些患者还是可以考虑一线治疗中跳过化疗,直接使用靶向治疗。
上述两类患者,也可以考虑靶向联合化疗和免疫治疗,以追求更强效的缩瘤效果。
部分高龄、体力评分较差的患者无法耐受全身化疗,或者部分患者的黄疸在充分减黄后也难以达到可以耐受化疗的范围,因为单独使用免疫治疗疗效不足,可以考虑使用这些靶向治疗。如果没有这些靶点变异,免疫治疗联合仑伐替尼之类的抗血管生成治疗也是可行的方案。
2025-10-23 23:42:30
在 2022 年的 ESMO 年会,LEAP-002 研究公布了研究结果,仑伐替尼联合帕博利珠单抗用于晚期肝癌的一线治疗,与仑伐替尼相比,未能显著改善患者总生存期(OS)和无进展生存期(PFS)。这项研究结果在当时引发了广泛的讨论。在 LEAP-002 研究开展的时候,国内也有一些 PD-1 抗体在寻求跟仑伐替尼的联合,其中包括基石药业的诺法利单抗(nofazinlimab,开发名:CS1003)和君实生物的特瑞普利单抗。在今年的 ESMO 年会上,CS1003 的 III 期研究(CS1003-305)在长期随访之后,公布了最终分析的结果。我们中心的樊嘉教授代表研究者做了大会报告。
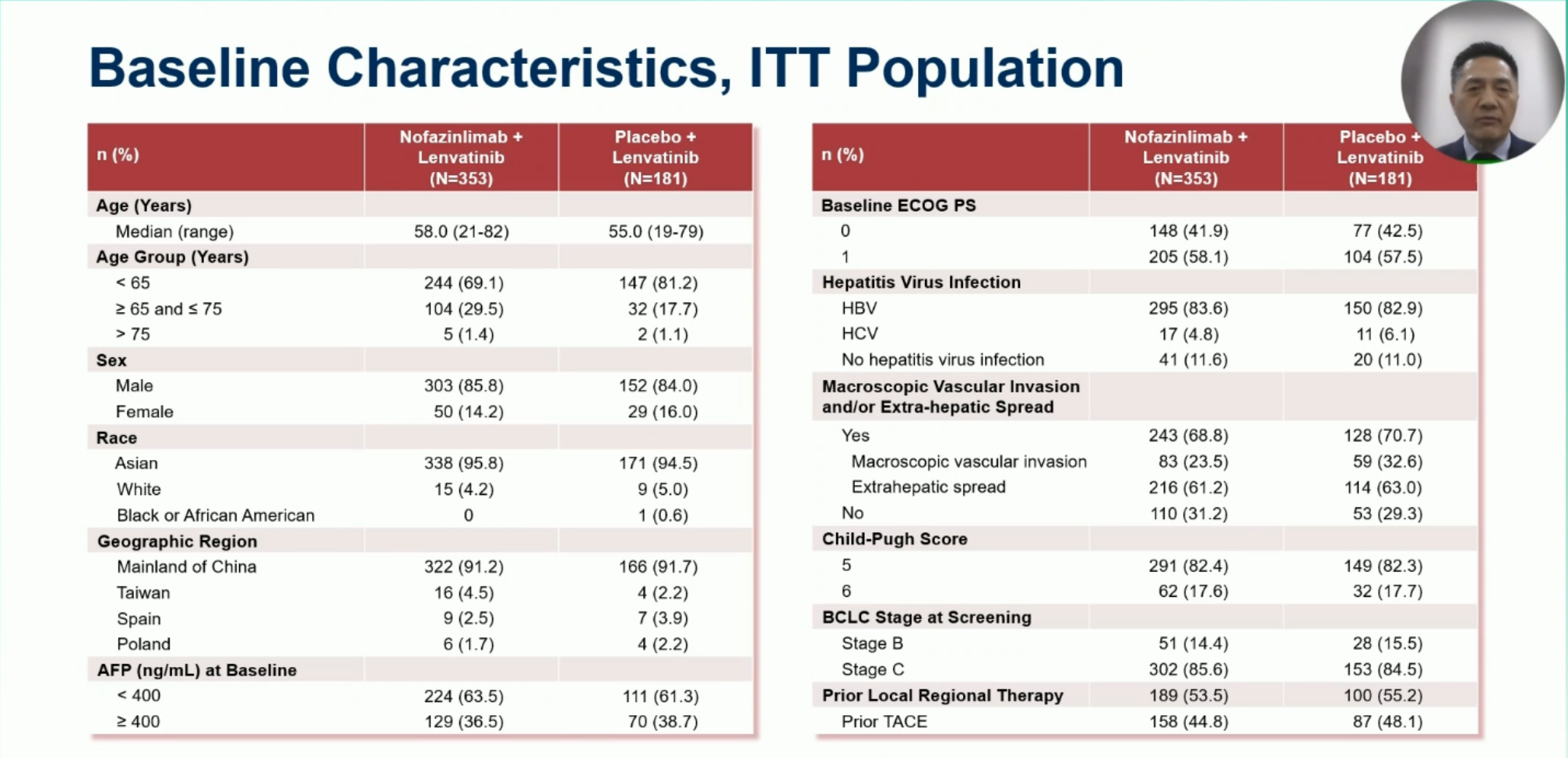
CS1003-305 是一项多中心的随机对照 III 期临床研究,534 例患者按照 2:1 的比例随机接受CS1003 联合仑伐替尼 或者 安慰剂联合仑伐替尼 治疗。超过 90% 的患者在中国大陆入组,因此乙肝感染的比例超过了 80%。
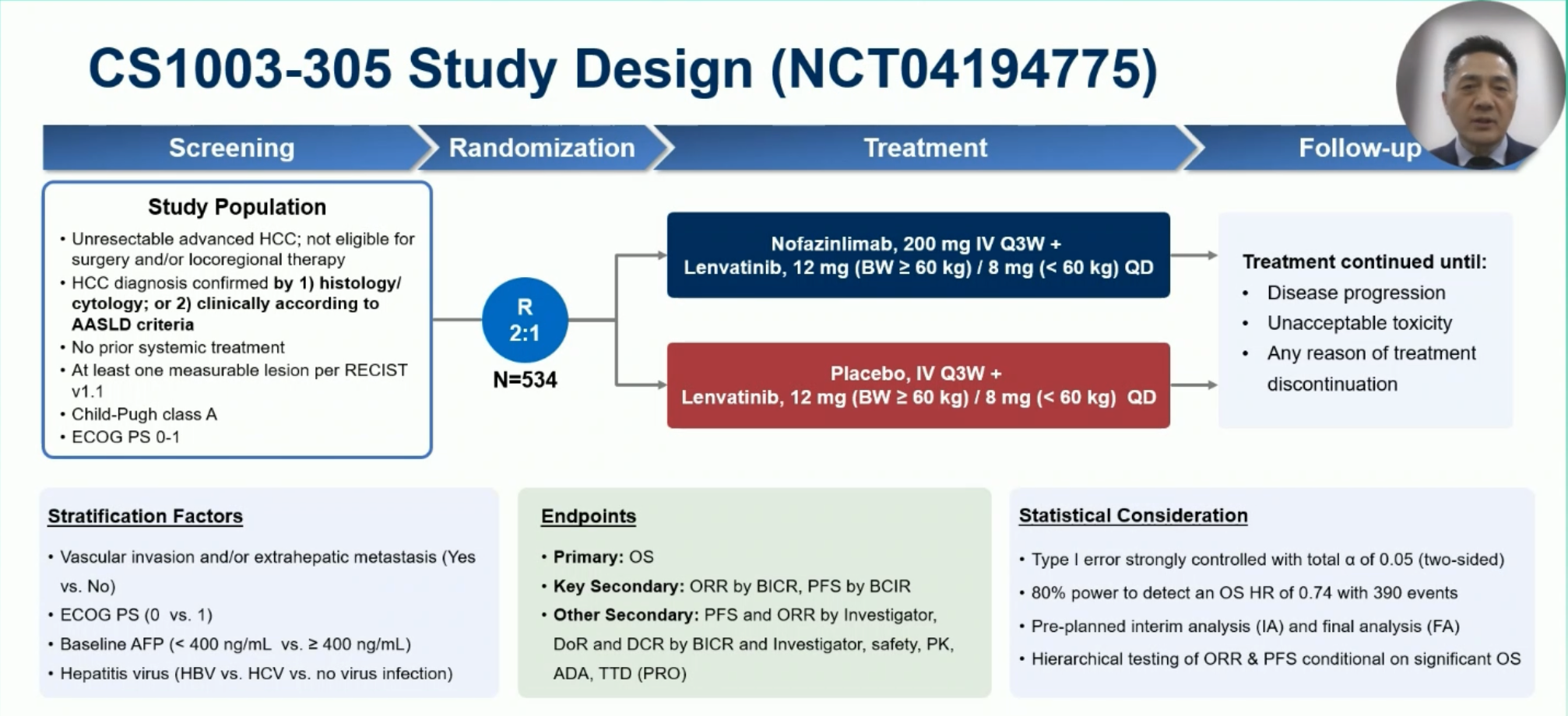
研究原本是 OS 和 PFS 是双主要终点设计,但 LEAP-002 结果公布后,本研究将主要研究终点改成了 OS 单主要终点的设计。本次会议上报告的是 OS 最终分析的结果。在中位随访 42.5 月后,在仑伐替尼基础上增加 CS1003 尽管出现了 OS 数值上的改善,两组的生存曲线也确实看到了分离,但未达到统计学差异(21.6 vs 18.5 月,HR=0.86,95%CI 0.69-1.06,P=0.1456)。这个研究结果与 LEAP-002 研究的全球人群的 OS 数据基本一致(帕博利珠单抗+仑伐替尼 vs 安慰剂+仑伐替尼:21.2 vs 19.0 月,HR=0.84)。
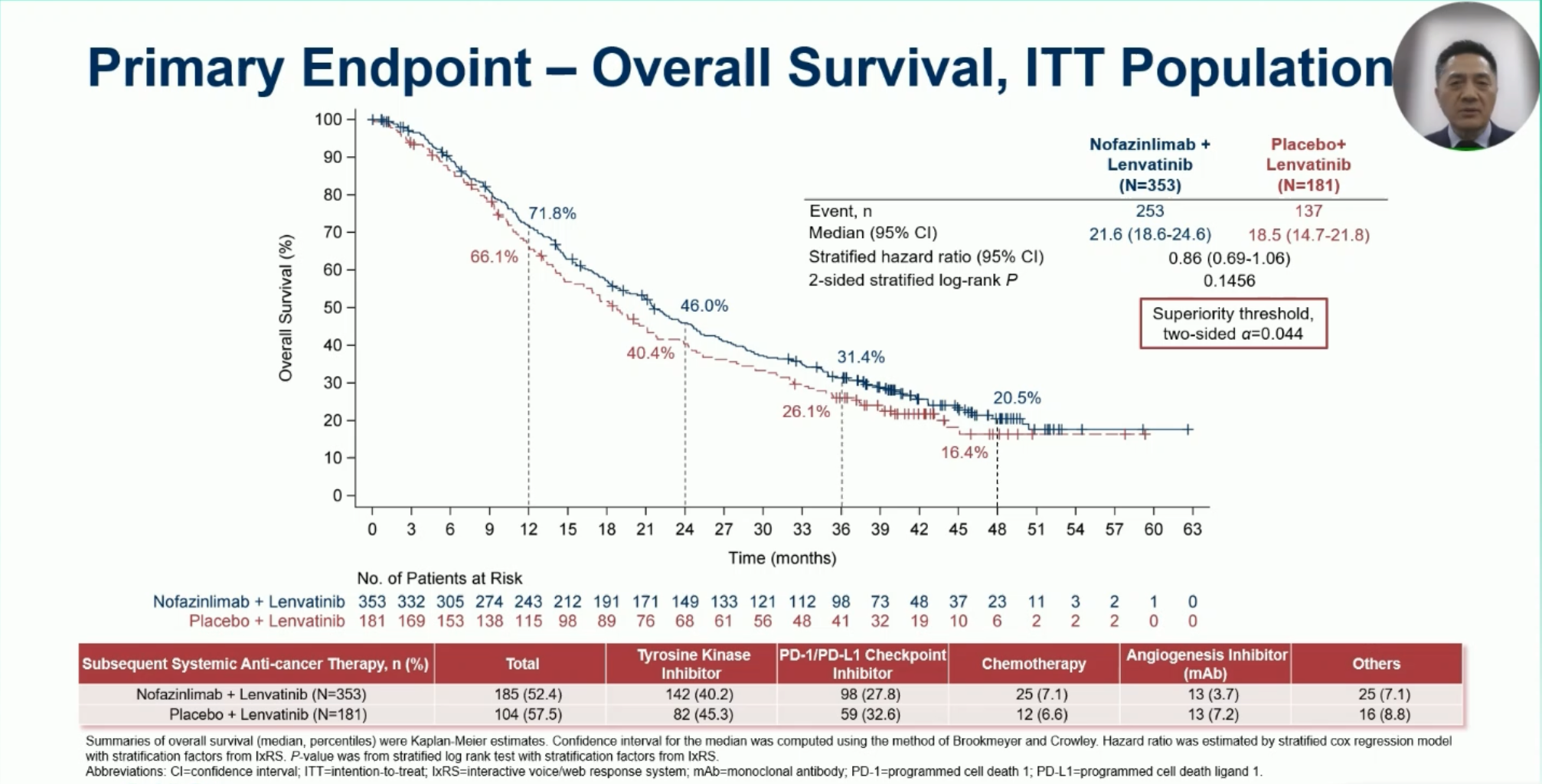
在 OS 的亚组分析中,大多数的亚组都可以观察到 OS 改善的趋势。但奇怪的是,在合并癌栓和/或肝外转移的亚组中却未观察到 OS 获益趋势(HR=1.00,95%CI 0.78-1.29)。这点跟 LEAP-002 存在不同,主要可能还是因为亚组分析的数据不够稳定。

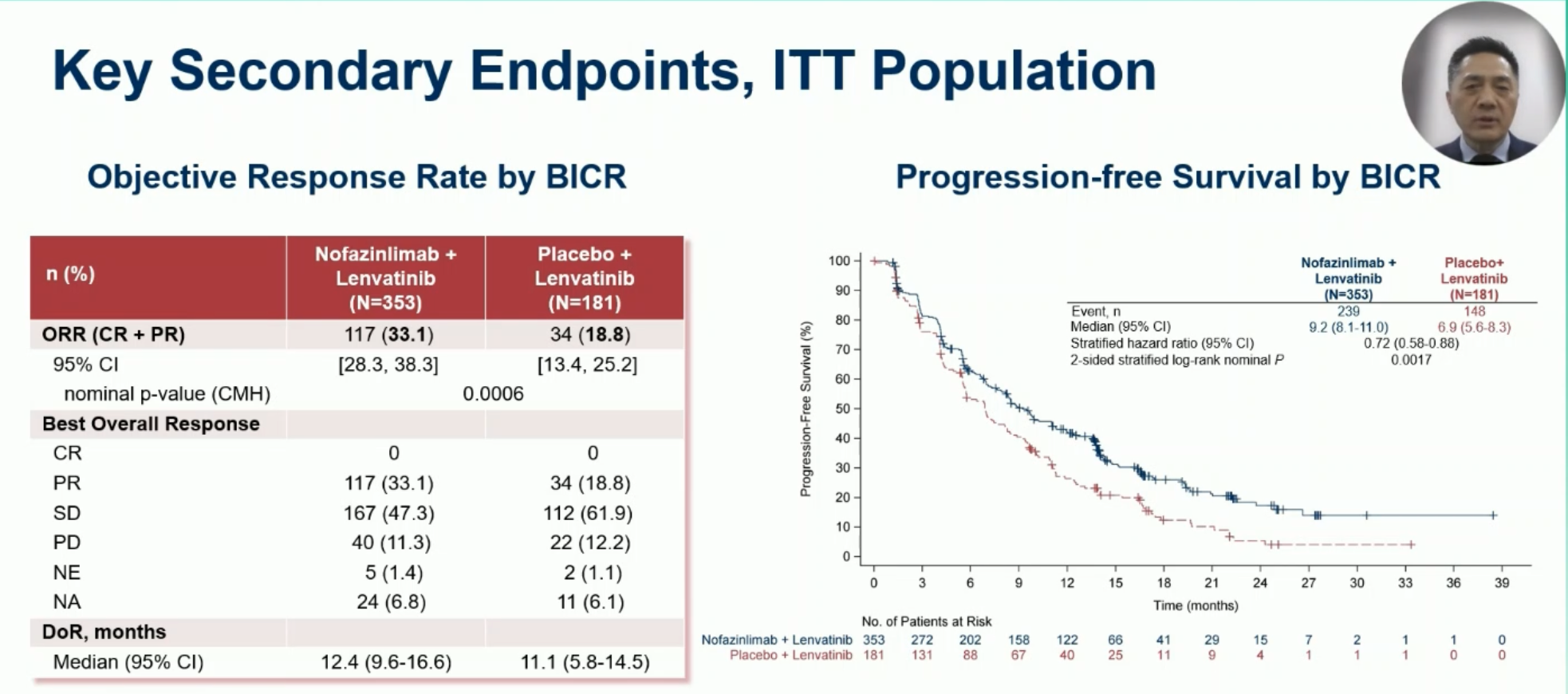
其他疗效数据方面,仑伐替尼联合 CS1003 改善 PFS 的优势似乎更明显(9.2 vs 6.9 月,HR=0.72,95%CI 0.58-0.88,名义的 P 值为 0.0017)。此外,客观缓解率也有提升(33.1% vs 18.8%)(RECIST v1.1 标准),两组的疾病进展(PD)率基本相当(11.3% vs 12.2%),保持了仑伐替尼治疗的高疾病控制率和低 PD 率的优势。
治疗安全性方面,与我们的预估比较相似,≥G3 治疗相关不良事件发生率分别为 54.8% 和 47.0%,治疗相关严重不良事件发生率分别为 23.0% 和 17.7%。
这项研究没有出现 OS 的显著获益,应该也算是意料之中。综合目前的多项研究,我们有了足够的数据支持这样的结论:在中晚期肝癌的治疗中,只增加 PD-(L)1 抗体免疫治疗,会显示出 OS 或 PFS 改善的趋势,但在样本量有限的情况下,很难达到统计学差异。要想达到统计学上的显著获益,要么靠运气,要么靠更大的样本量,要么就挑选一些更可能获益的人群。例如:
同样,在本届 ESMO 上公布的其他研究结果也显示,在现有治疗基础上一种其他类型的免疫检查点抑制剂,也没有带来净获益。例如,在 IMbave152 研究提示,在阿替利珠单抗和贝伐珠单抗(T+A 方案)基础上 TIGIT 抗体未能提高疗效;TRIPLET 研究也提示,在 T+A 基础上增加 4 次小剂量伊匹木单抗(CTLA-4 抗体)也未能改善疗效。
至此,本届 ESMO 会议上公布的 3 项晚期肝癌的一线治疗的随机对照研究,都没有达到主要研究终点。晚期肝癌的一线治疗还停留在靶向联合免疫治疗或双免疫治疗时代。
2025-10-20 23:39:25
一直以来,中期肝癌(BCLC B 期)被认为存在较大的异质性,从 2-3 枚肿瘤,其中一枚直径超过 3cm,到弥漫性肝癌,只要不伴有肉眼癌栓或远处转移,都属于中期肝癌。虽然在西方的指南中,中期肝癌的标准治疗是经肝动脉化疗栓塞(TACE),但最近出现了一些改变。BCLC 2022 年的指南更新开始对中期肝癌做了进一步的分层,根据肿瘤的负荷从小到大,首选接受肝移植、TACE 和系统治疗。但这些分层之间的界限非常模糊。我国的肝癌分期,则将中期肝癌分成了 CNLC IIa 期(2-3 枚肿瘤,其中一枚直径超过 3cm)和 IIb 期(肿瘤数目≥4),分别首选手术切除和 TACE 治疗。也有不少评分系统根据肿瘤负荷(肿瘤数目与最大肿瘤的直径之和)将中期肝癌做了分层,包括 up-to-7 标准和我国学者提出的 6-and-12 标准,等等。
近年来,系统治疗的疗效越来越好,那是否可以挑战 TACE 成为中期肝癌的标准治疗呢?这项叫做 ABC-HCC 的国际多中心研究,主要在欧洲、澳洲和日本的开展,将不适合手术切除但适合 TACE 的中期肝癌和合并远端门静脉分支癌栓(Vp1-2)的部分晚期肝癌按照 1:1 的比例,随机接受阿替利珠单抗联合贝伐珠单抗(T+A 方案)系统治疗 或 TACE 治疗(包括传统的碘油 TACE 和药物洗脱微球 TACE)。
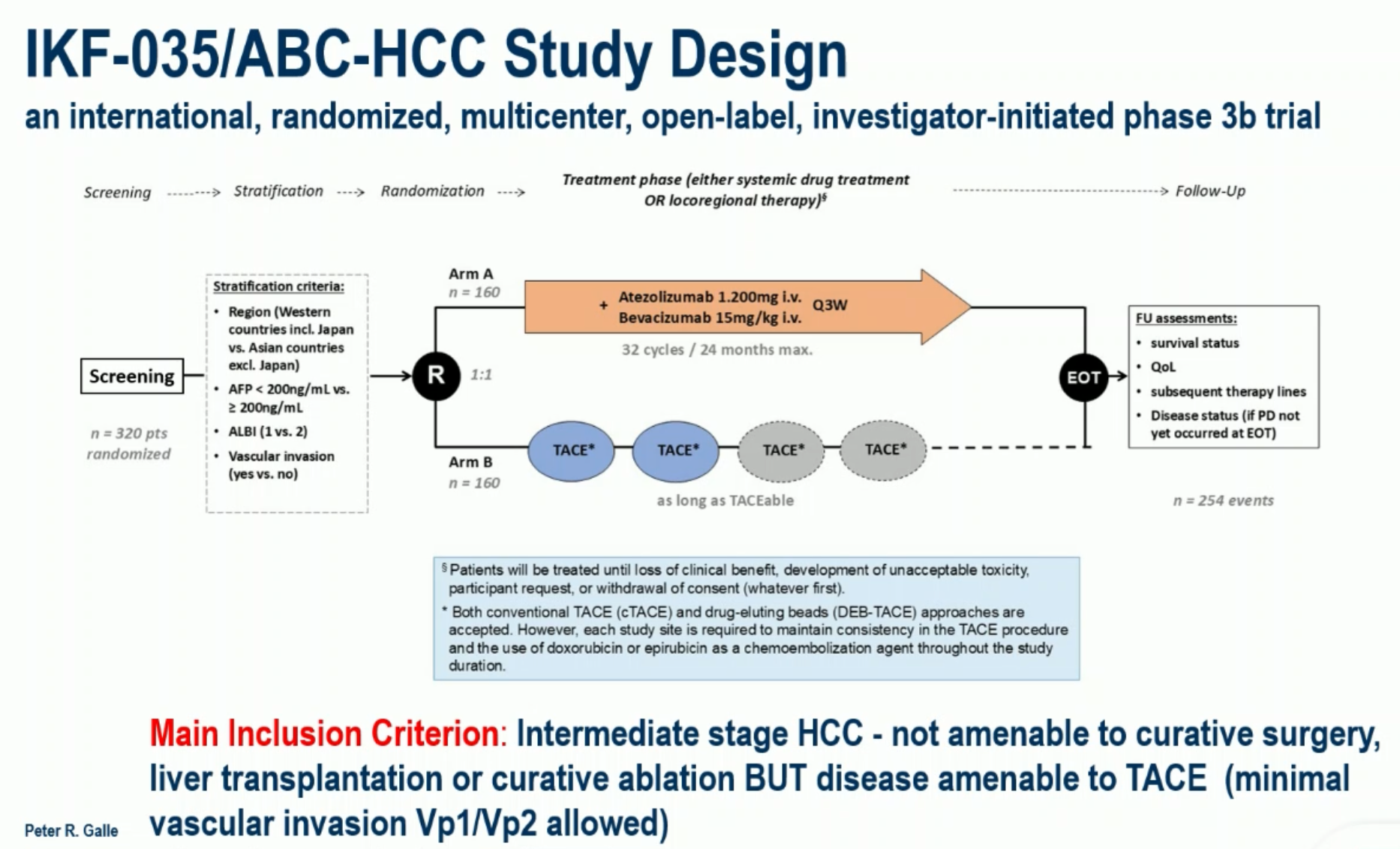
研究选择的终点比较新颖,叫做“至治疗方案失败时间(time to failure of treatment strategy,TTFS)”。对于系统治疗组,影像学进展为治疗失败;对于 TACE 组,影像学进展或疾病稳定也是治疗失败。此外,符合其他条件也被认为治疗失败,包括:失去临床获益(关键部位的肿瘤进展、疾病进展导致新发的症状或体征,或 ECOG 体能评分下降、研究者判断失去临床获益)、不可耐受的毒性、肝功能恶化、其他原因导致的治疗不再适用。

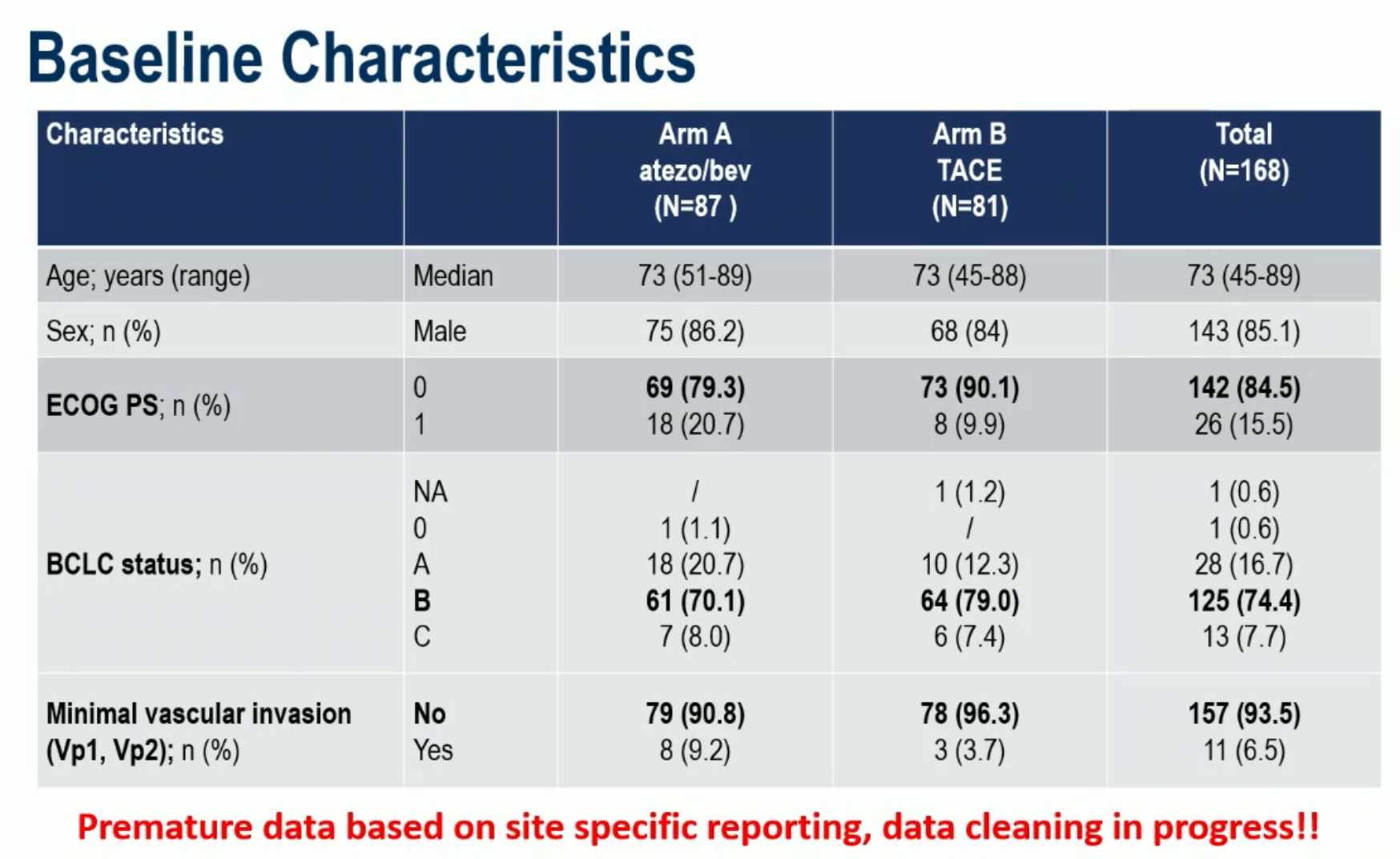
研究计划入组 320 例受试者,目前入组还没有完成,这次公布的结果是第一次期中分析的结果,是在发生了 85 个 TTFS 事件时进行的。因为研究样本量偏小,两组的多项基线特征不太均衡,但两组的病情也各有轻重。
此次期中分析时,T+A 组显示出了更多的 TTFS 获益(14.6 vs 9.5 月,HR=0.545,95%CI 0.359-0.826,P=0.0043)。T+A 组的治疗失败原因主要是疾病进展(37.9%)和不可耐受的毒性(8.0%);TACE 组则为疾病进展(56.8%)和疾病稳定(6.2%)。
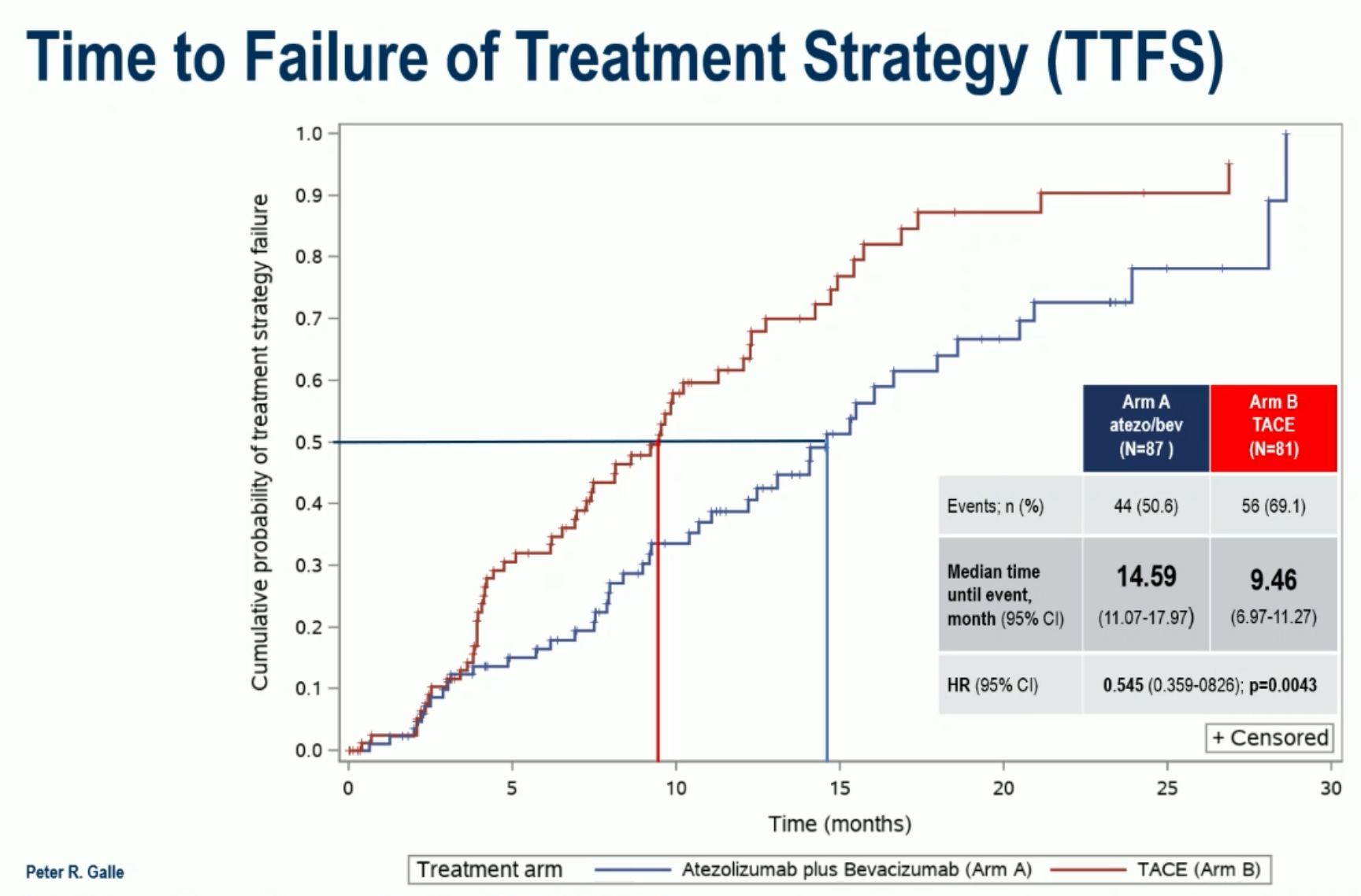
两种治疗的使用强度也明显不同,T+A 中位使用了 12 个周期,TACE 的中位治疗次数是 2 次。可惜的是,研究者没有透露 OS 这一关键次要终点的目前表现如何。
那根据这个初步结果,系统治疗能够替代 TACE 作为中期肝癌的标准治疗吗?目前还难下结论。 TTFS 这个终点选择存在较大问题,对 TACE 治疗组可能不太公平。例如 TACE 组的肿瘤稳定也被判断成治疗失败,而介入治疗界普遍认为出现了无法 TACE 治疗的病灶才认为是治疗失败(即 RECICL 标准的 unTACEable progression),更不用提疾病稳定了。另外,对于 T+A 组的患者,在治疗失败之后很难找到广泛认可的后线治疗,进展后生存时间可能较短;而 TACE 组在治疗失败后,除非出现肝功能恶化,无法耐受系统治疗的情况,还有多项系统治疗可以选择。因此,T+A 组的 TTFS 获益,可能不能转化成 OS 获益。
此外,该研究目前没有公布亚组分析的结果,也不确定哪种肿瘤负荷的患者更适合系统治疗或 TACE 治疗。我相信,系统治疗可能会 部分 取代 TACE,成为某些特征的中期肝癌患者的首选治疗(例如弥漫性、浸润性肝癌),但肯定不是全部。
2025-10-20 23:35:31
目前晚期肝细胞癌的标准一线治疗方案都是二联治疗,要么是靶向联合免疫治疗(抗血管生成靶向治疗+ PD-(L)1 抗体),要么是双免疫治疗(PD-(L)1 抗体 + CTLA-4 抗体)。这两种联合治疗方案的客观缓解率(ORR)20-36%,患者的中位生存期 16-24 月。把两者做一个组合,形成 “抗血管生成靶向治疗+ PD-(L)1 抗体 + CTLA-4 抗体”的三联治疗,似乎可能会进一步提高疗效。
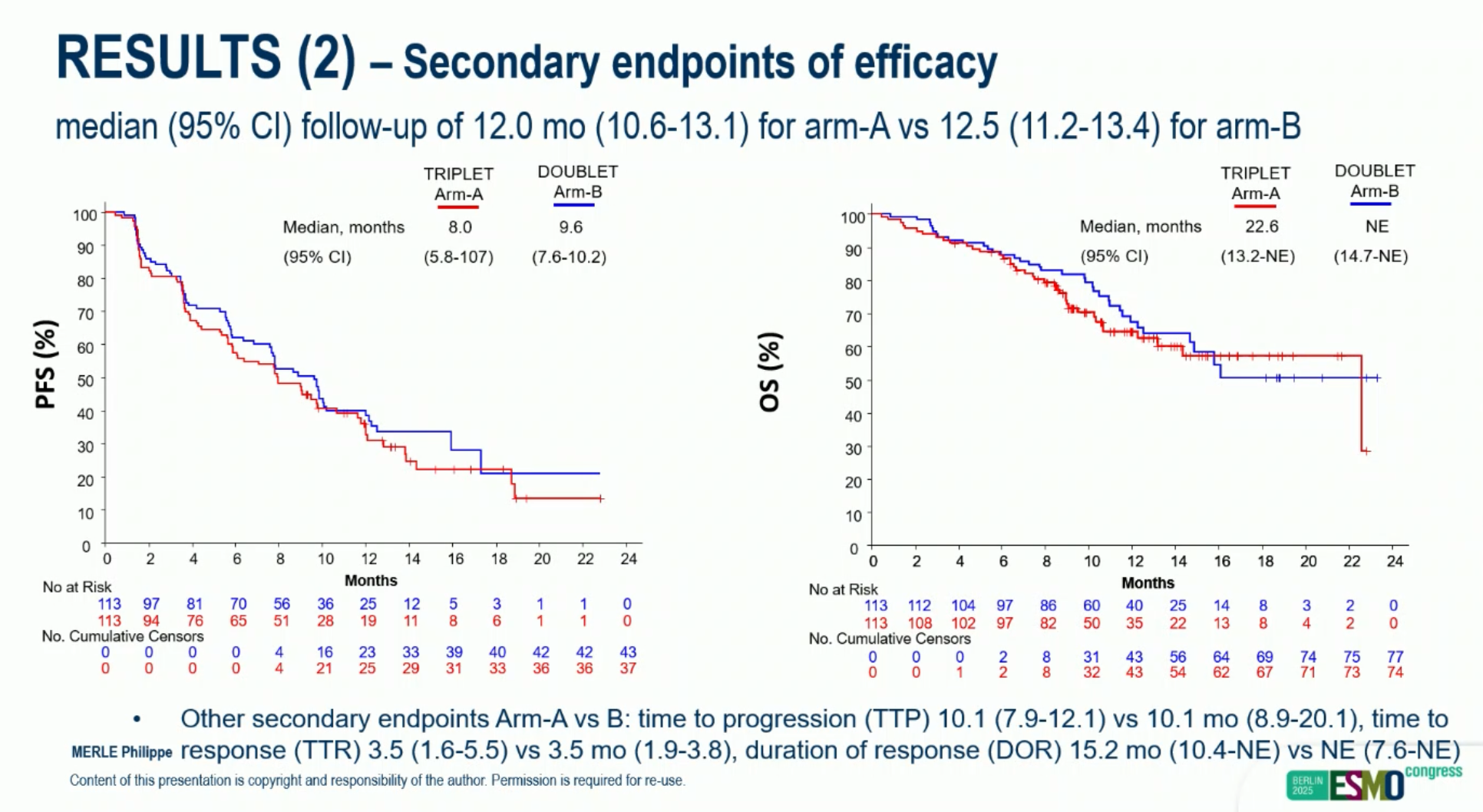
这项在法国开展的 TRIPLET-HCC 研究是一项多中心的随机对照试验,评估的是阿替利珠单抗联合贝伐珠单抗(T+A 方案)基础上增加 CTLA-4 抗体伊匹木单抗治疗的有效性和安全性。该研究入组的未经系统治疗的晚期肝细胞癌患者,按照 1:1 的比例随机接受三联治疗(伊匹木单抗 1mg/kg(共使用 4 个周期)联合T+A 方案三联治疗 或者T+A 方案二联治疗。
该研究是一项 2-3 期研究。在 2 期研究部分设计了一个无效性终点。只有三联治疗组的 ORR≥35%(RECIST v1.1 标准),才进入 3 期研究部分。但在研究入组了共 226 例受试者时,因为三联治疗组的 ORR 没有达到这个界值,研究提前终止。

伊匹木单抗+T+A 三联组的 113 例患者中 34 例出现了肿瘤缓解,ORR 30.1%。T+A 组的表现跟历史水平相一致,ORR 为 27.4%。下表显示了其他短期疗效数据。

其他疗效数据方面,增加小剂量伊匹木单抗,也未能进一步改善患者的无进展生存期(PFS)或总生存期(OS)。
而不良反应方面,增加小剂量伊匹木单抗增加了不良反应。3-4 级治疗相关的不良事件(TRAE)分别为 44.2% 和 38.9%。治疗组出现了 5 例治疗相关的死亡事件,其中 2 例消化道出血(应该跟伊匹木单抗无直接关系)、1 例肝功能衰竭、1 例败血症和 1 例原因未知;对照组则没有出现治疗相关的死亡。
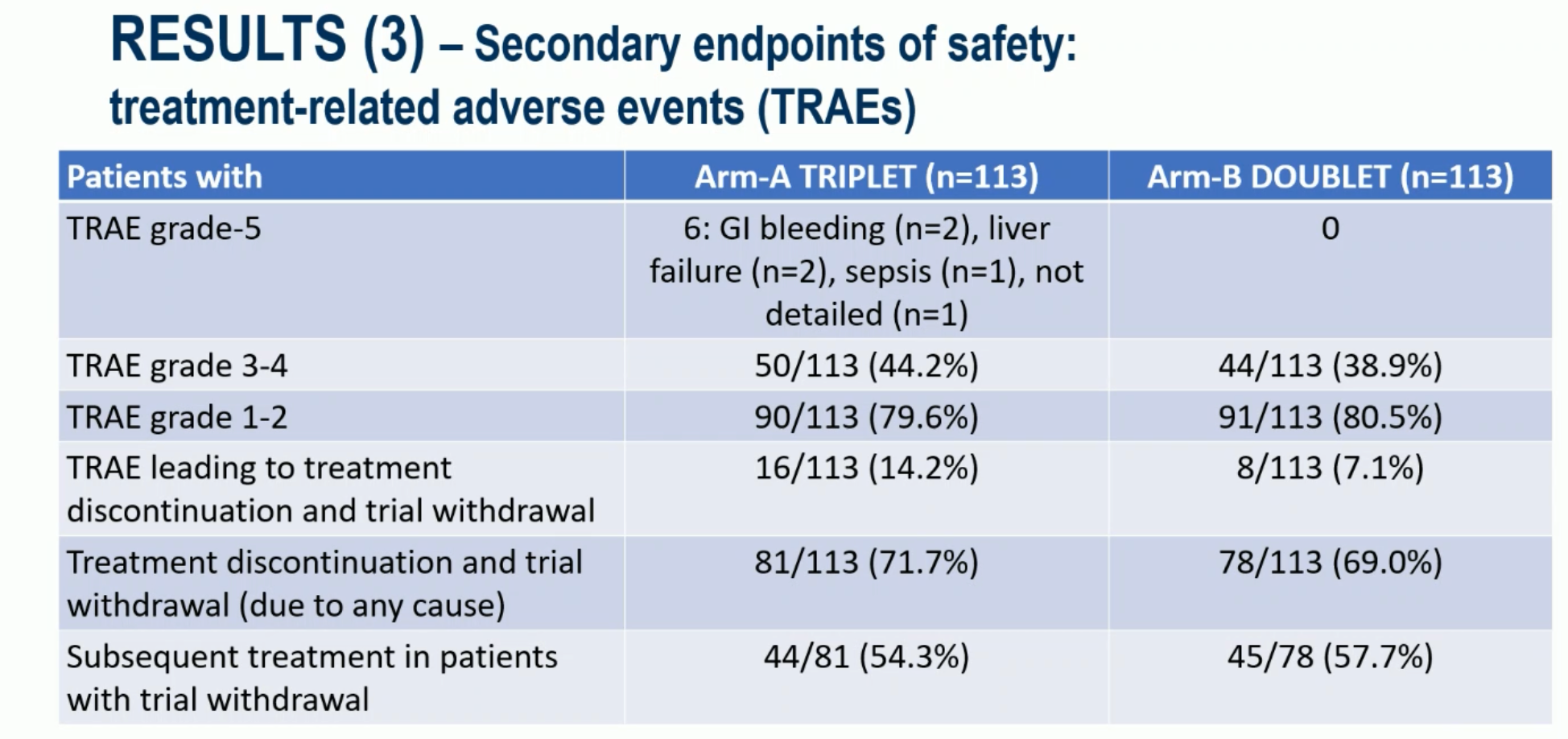
1+1+1 并没有大于 1+1,这让我很失望。看起来,将现有的抗肿瘤药物做简单的累加并不能有效改善疗效,反而带来了更多的不良反应。在国内,恒瑞公司也有一项相似的研究(CTR20243670)正在开展,比较的是 CTLA-4 抗体+PD-L1 抗体+贝伐珠单抗三联治疗 vs 信迪利单抗(PD-1 抗体)+贝伐珠单抗,但用药方式稍有区别。该研究的三联治疗组的 CTLA-4 抗体在首次给予大剂量治疗,后面是小剂量长周期维持。希望这种不能的给药方式能带来疗效的提升。